塞尔帕替尼(selpercatinib)首个RET抑制剂于患有晚期或转移性实体瘤的成人RET基因融合,无论类型如何
在LIBRETTO-001试验中,selpercatinib在RET驱动的癌症患者中对各种肿瘤类型表现出临床意义和持久的反应,包括胰腺癌,结肠癌和其他需要新治疗方案的癌症。
除了与肿瘤无关的批准外,FDA还授予了Retevmo用于局部晚期或转移性非小细胞肺癌(NSCLC)成年患者的传统批准,通过FDA批准的测试检测到RET基因融合。FDA的这一行动扩大了Retevmo标签的范围,包括局部晚期疾病患者,并将
RET融合阳性实体瘤
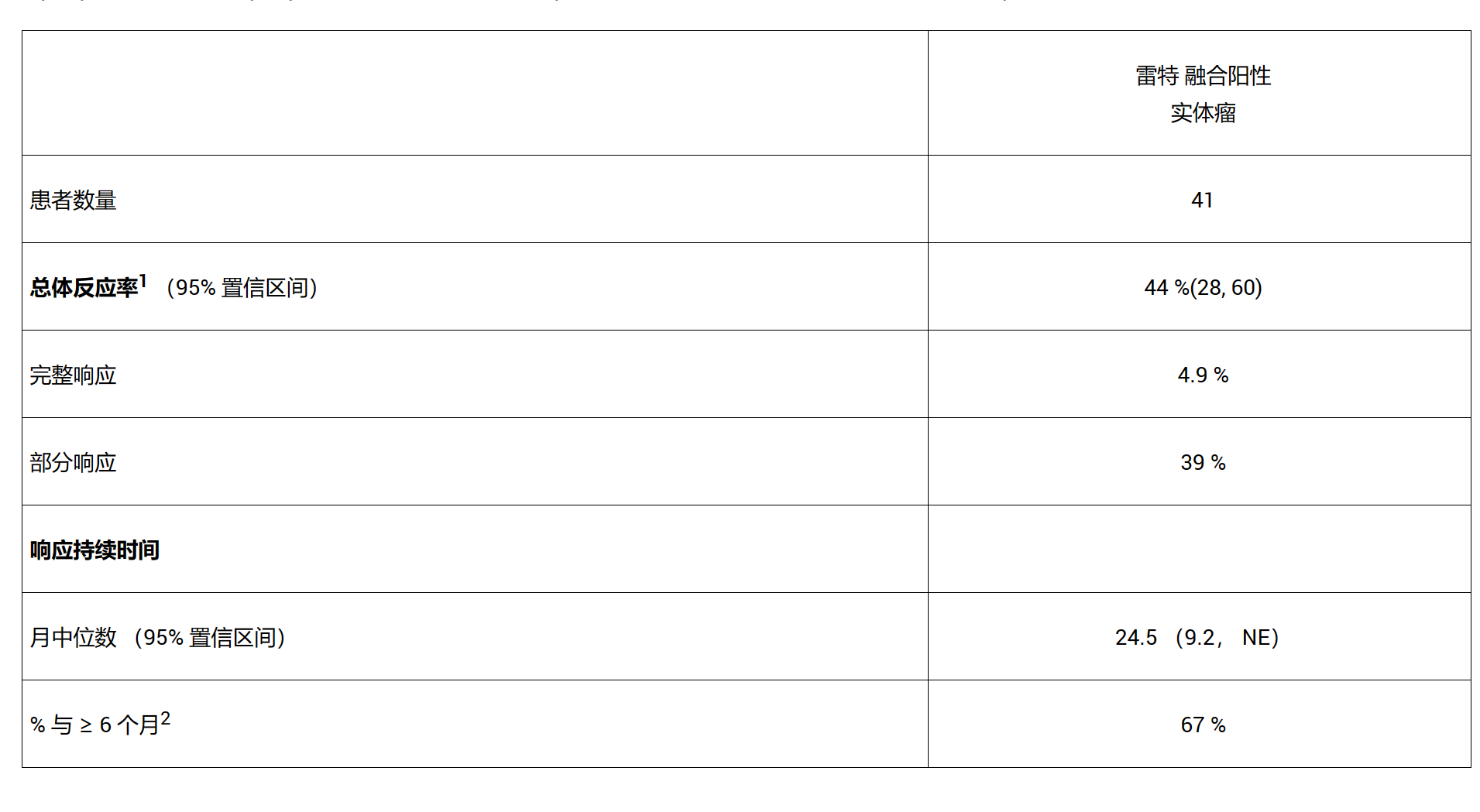
在肿瘤不可知数据集中的41名患者中,最常见的癌症是胰腺腺癌(27%),结直肠癌(24%),唾液癌(10%)和未知原发性癌(7%)。90例患者(2%)既往接受过全身治疗(中位数0 [范围9 – 32];3%接受<>例或更多)。疗效结果总结如下:
Retevmo 的标签包含肝毒性(肝功能障碍的证据)、间质性肺疾病 (ILD)/肺炎、高血压、QT 间期延长、出血事件、超敏反应、肿瘤溶解综合征、伤口愈合受损风险、甲状腺功能减退和胚胎-胎儿毒性的警告和预防措施。
“自最初加速批准以来,Retevmo已经改变了RET改变癌症患者的治疗模式,”Loxo@Lilly首席医疗官
免责声明
由本文所表达的任何关于疾病的建议都不应该被视为医生的建议或替代品,请咨询您的治疗医生了解更多细节。本站信息仅供参考,医康行不承担任何责任。

扫码实时看更多精彩文章
