拉罗替尼(Larotrectinib)口服液在临床研究中的疗效如何?
VITRAKVI适用于治疗成人和儿童实体瘤患者:具有神经营养受体酪氨酸激酶 (NTRK) 基因融合,没有已知的获得性抗性突变,是转移性的或手术切除可能导致严重并发症的地方,以及没有令人满意的替代治疗或治疗后进展。那么拉罗替尼(Larotrectinib)口服液在临床研究中的疗效如何?
拉罗替尼(Larotrectinib)口服液临床研究
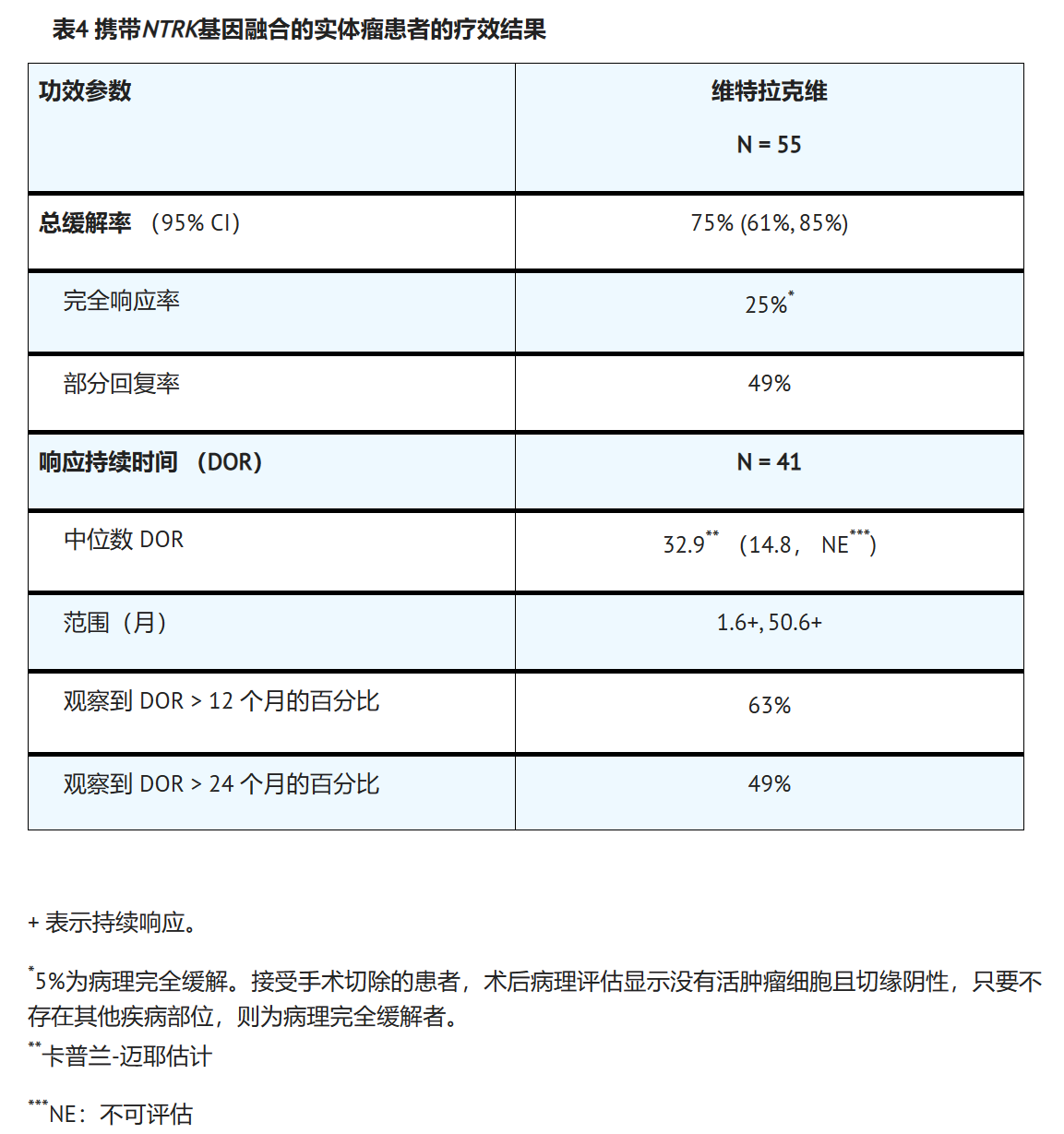
VITRAKVI在患有NTRK基因融合的不可切除或转移性实体瘤的儿科和成人患者中的疗效进行了评估,这些患者参加了三项多中心,开放标签,单臂临床试验之一:研究LOXO-TRK-14001(NCT02122913),SCOUT(NCT02637687)和导航(NCT02576431)。所有患者都需要在全身治疗后进展(如果有的话),或者需要手术治疗局部晚期疾病,并发症发生率显著。
成人患者接受VITRAKVI 100 mg口服,每日两次,儿科患者(18岁或以下)接受VITRAKVI 100 mg/ m 2,最大剂量为100 mg,口服每日两次,直到出现不可接受的毒性或疾病进展。在当地实验室使用下一代测序(NGS)或荧光原位杂交(FISH)前瞻性地确定NTRK阳性基因融合状态的鉴定。在三名婴儿纤维肉瘤患者中推断出NTRK基因融合,这些患者有由FISH鉴定的记录ETV6易位。主要疗效结局指标是总体缓解率(ORR)和缓解持续时间(DOR),由盲法独立审查委员会(BIRC)根据RECIST v1.1确定。
疗效评估基于在三项临床试验中入组的前55例NTRK基因融合的实体瘤患者。基线特征为:中位年龄45岁(范围为4个月至76岁);22%<18岁,78%≥18岁;53%男性;67% 白色;7% 西班牙裔/拉丁裔,4% 亚洲人,4% 黑人;和 ECOG 性能状态 (PS) 0-1 (93%) 或 2 (7%)。18%的患者患有转移性疾病,包括脑转移患者,82%的患者患有局部晚期,不可切除的疾病。45%的患者既往接受过癌症治疗,包括手术、放疗或全身治疗。其中,35%(n=19)既往接受过全身治疗,中位数为两种既往全身性治疗方案,22%(n=20)接受过三种或更多既往全身性治疗方案。最常见的癌症是唾液腺肿瘤(13%),软组织肉瘤(9%),婴儿纤维肉瘤(50%)和甲状腺癌(5%)。共有<>例患者通过NGS检测到NTRK基因融合,<>例患者通过FISH检测到NTRK基因融合。
拉罗替尼(Larotrectinib)口服液用法用量
推荐剂量
体表面积至少为1.0平方米的成人和儿童患者的推荐剂量
VITRAKVI的推荐剂量为100毫克,口服,每日两次,随餐或不随餐服用,直到疾病进展或直至不可接受的毒性。
体表面积小于1.0平方米的儿科患者的推荐剂量
VITRAKVI的推荐剂量为100 mg/m2,口服,每日两次,随餐或不随餐服用,直至疾病进展或直至出现不可接受的毒性。
不良反应的剂量调整
对于3级或4级不良反应:暂停使用VITRAKVI,直到不良反应消退或改善至基线或1级。如果在 4 周内消退,则在下一次剂量调整时恢复。如果不良反应在4周内没有消退,请永久停用VITRAKVI。
免责声明
由本文所表达的任何关于疾病的建议都不应该被视为医生的建议或替代品,请咨询您的治疗医生了解更多细节。本站信息仅供参考,医康行不承担任何责任。

扫码实时看更多精彩文章
