Akeega是一种用于BRCA突变mCRPC的口服组合疗法,获得FDA批准
美国食品药品监督管理局 (FDA) 已批准 Akeega(尼拉帕尼和醋酸阿比特龙)用于治疗由 FDA 批准的测试确定的有害或疑似有害 BRCA 突变 (BRCA m) 转移性去势抵抗性前列腺癌 (mCRPC) 成人。
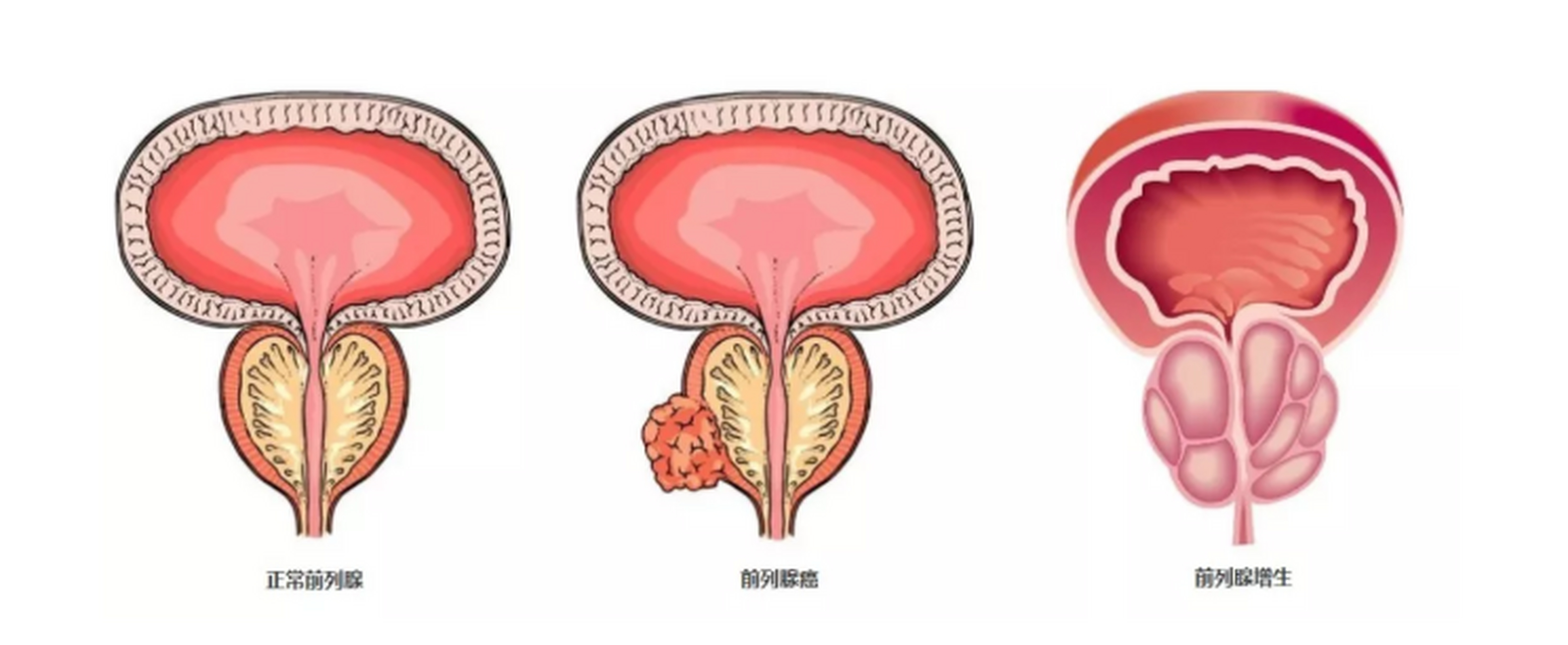
Akeega是一种口服疗法,将尼拉帕尼(一种PARP抑制剂)和醋酸阿比特龙(一种CYP17抑制剂)组合成一片。该批准基于随机,双盲,3期MAGNITUDE研究(ClinicalTrials.gov 标识符:NCT03748641)的数据。
具有同源重组修复(HRR)基因突变mCRPC(队列1)的研究参与者被随机分配接受200mg的尼拉帕尼和1000mg的阿比特龙(n = 212)或安慰剂和阿比特龙(n = 211),直到不可接受的毒性或进展。所有患者均接受泼尼松龙每日10mg和促性腺激素释放激素类似物或既往接受过双侧睾丸切除术。
在这项研究人群中,53%的患者(n=225)有BRCA突变。主要终点是影像学进展无生存期(rPFS)。总生存期(OS)是额外的结局指标。
研究结果显示,在BRCAm亚组中,尼拉帕尼-阿比特龙组的rPFS比安慰剂-阿比特龙有显著改善(风险比[HR],0.53;95%CI,0.36-0.79;P = .0014)和总体HRR人群(HR,0.73;95%CI,0.56-0.96;P = .0217),但不在非BRCA HRR突变患者亚组中(HR,0.99;95%CI,0.67-1.44)。
在一项探索性分析中,BRCAm亚组的中位OS在尼拉帕里布-阿比特龙组为30.4个月,安慰剂-阿比特龙组为28.6个月(HR,0.79;95%CI,0.55-1.12)。在非BRCA HRR突变患者中,OS的HR为1.13(95%CI,0.77-1.64)。
在HRR基因突变人群中,联合治疗观察到的改善主要归因于BRCAm患者亚组的结果。
至于安全性,报告的最常见的不良反应(≥20%)是血红蛋白减少,淋巴细胞减少,白细胞减少,肌肉骨骼疼痛,疲劳,血小板减少,碱性磷酸酶增加,便秘,高血压,恶心,中性粒细胞减少,肌酐增加,钾增加,钾减少和AST增加。

总体而言,27%的患者需要输注红细胞,11%的患者需要多次输血。还观察到ALT增加,水肿,呼吸困难,食欲下降,呕吐,头晕,COVID-19,头痛,腹痛,出血,尿路感染,咳嗽,失眠,胆红素增加,体重减轻,心律失常,跌倒和发热(≥10%)。
Akeega以片剂形式提供,有2种剂量强度:50毫克的尼拉帕尼/500毫克的醋酸阿比特龙和100毫克的尼拉帕尼/500毫克的醋酸阿比特龙。
FDA还批准使用FoundationOne CDx作为Akeega的伴随诊断。应根据是否存在 BRCA 基因改变来选择患者进行治疗。
免责声明
由本文所表达的任何关于疾病的建议都不应该被视为医生的建议或替代品,请咨询您的治疗医生了解更多细节。本站信息仅供参考,医康行不承担任何责任。

扫码实时看更多精彩文章
