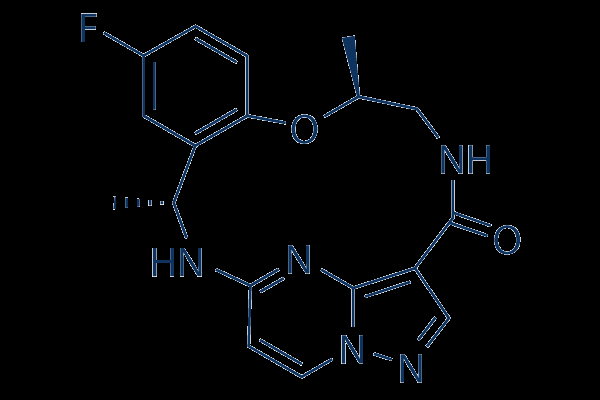
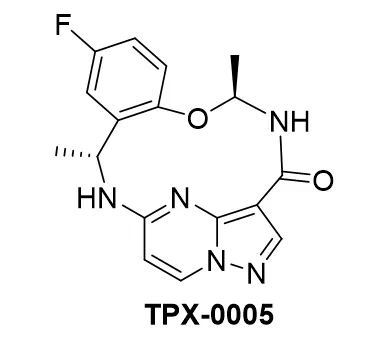
瑞波替尼诱导ROS1+NSCLC亚群的持久反应
对ROS1-阳性的非小细胞肺癌癌症患者,特别是酪氨酸激酶抑制剂(TKI)未经治疗或预处理的患者,使用雷普替尼治疗,继续显示出持久的临床活性和持久的颅内反应,根据在2023年癌症世界会议上发表的1/2期TRIDENT-1试验(NCT03093116)的最新结果。
“TRIDENT-1的这些结果表明,对于ROS1-阳性转移性NSCLC的TKI-幼稚和TKI-预处理患者,雷普替尼是一种潜在的新的治疗标准选择。”Byoung Chul Cho,医学博士,博士,延世大学医学院延世癌症中心医学肿瘤科的医学肿瘤学家和教授,延世癌症中心癌症中心主任在会议上发言时说。
在他的报告中,Cho报告了两个主要疗效组(TKI幼稚患者(n=71)或以前接受过1次TKI治疗而没有化疗的患者(n=56))的疗效(至少随访14个月),以及所有接受推荐2期剂量(RP2D)治疗的患者的安全性。截止日期为2022年12月19日。
TKI幼稚队列中位随访24.0个月(范围14.2-66.6)后,确认的客观有效率(cORR)为79%(95%CI,68%-88%)。此外,中位反应持续时间(DOR)为34.1个月(95%CI,25.6–不可估计[NE]),中位无进展生存期(PFS)为35.7个月(95%CI,27.4-NE),中中位总生存期(OS)为NE(95%CI、44.4-NE)。12个月和18个月的PFS发生率分别为77%和70%,12个月的OS发生率为91%和88%。
在评估反应时间(TTR)时,TKI幼稚队列中83%的患者在12个月时出现反应,79%的患者在18个月时发生反应。
在TKI幼稚队列中接受RP2D治疗的患者中(n=63),cORR为78%(95%CI,66%-87%),DOR中位数为NE(95%CI、25.6-NE),PFS中值为NE(95%CI、27.4-NE),OS中位数为NE。
在既往接受过1次TKI且未接受化疗的患者队列中,中位随访21.5个月(范围14.2-58.6)后,cORR为38%(95%CI,25%-52%)。此外,DOR中位数为14.8个月(95%CI,7.6–NE),PFS中位数为9.0个月(95%CI,6.8-19.7),OS中位数为25.1个月。12个月PFS和OS发生率分别为41%和69%。
就TTR而言,56%的患者在12个月时出现反应。
在该队列中接受RP2D治疗的患者中(n=53),cORR为38%(95%CI,25%-52%),DOR中位数为14.8个月(7.5-NE),PFS中位数为9.0个月(95%CI,6.8-19.6),OS中位数为20.5个月。
最后,在用基线G2032R耐药突变进行TKI预处理的患者(n=17)中,cORR为59%(95%CI,33%-82%),DOR中位数为7.6个月(95%CI为4.4-17.8),PFS中位数为9.2个月(95%CI为1.9-12.8)。
在TKI幼稚组和TKI预处理组中,颅内cORR分别为89%(95%CI,52%-100%)和38%(95%CI:14%-68%)。TKI初始组有1名患者(11%)出现完全反应,而TKI预处理组没有患者,分别有7名(78%)和5名(38%)出现部分反应。Cho指出,在仅对首次颅内进展的时间进行分析时,两组患者在治疗的18个月内均未发生任何进展。
Cho补充道:“在没有基线脑转移的患者中,雷普替尼可导致持久的颅内反应,并可能延缓或阻止脑损伤的发展。”。
总的来说,TKI初始组的34名患者(48%)和TKI预处理组的40名患者(71%)停止了雷普替尼的治疗。这些患者中的大多数(分别为24%和30%)在停药后继续接受化疗,无论是否进行免疫治疗。
在接受RP2D治疗的试验中,ROS1阳性NSCLC患者(n=320)中,99%和96%的患者发生了治疗突发(TEAE)和相关不良事件(TRAE),其中49%和27%为3级或更高级别。最常见的TEAE是头晕(62%;3级或以上,3%);然而,Cho指出,没有患者因此中断治疗。13例TEAE(4%)被报告为致命。
Cho说:“在RP2D治疗的患者中,雷普替尼的安全性是可控的,并且与之前所有治疗患者的报告一致。”。
在这项开放标签、全球、多中心、首次在人体内进行的1/2期TRIDENT-1试验中,研究人员旨在评估雷普替尼治疗晚期实体瘤患者的安全性、耐受性、药代动力学和抗肿瘤活性。
试验第一阶段的目标是评估主要和次要安全终点以及药代动力学。使用RECIST v1.1通过盲独立中央审查评估的ORR是试验第2阶段的主要终点,次要终点包括DOR、TTR、PFS、OS和6个扩展队列的临床获益率。
为了有资格参加1/2期试验,患者必须患有携带ROS1或NTRK1-3基因融合的局部晚期或转移性实体瘤;允许无症状的中枢神经系统转移。
雷普替尼的RP2D剂量为160 mg,每日一次,持续14天,随后为160 mg每日两次。
队列包括未接受TKI的患者(n=110)、之前接受过1次TKI且未接受化疗的患者(n=60)、之前进行过1次TKI且未接受铂类化疗的患者,或之前接受过2次TKI但未接受化疗(n=60)的患者。
在未进行化疗的TKI幼稚组和1例既往TKI患者中,患者的中位年龄为57岁(分别为28-80岁和33-78岁),而女性患者分别为43岁(61%)和38岁(68%)。此外,在TKI幼稚队列中,分别有34%和66%的患者ECOG表现得分为0或1,而在接受过1次TKI且未接受化疗的患者中,这一比例分别为32%和68%。TKI早期队列中有17名患者(24%)有脑转移,而第二组为26名(46%)。
在TKI幼稚队列中,72%的患者既往未接受过化疗(包括或不包括免疫疗法),24%的患者既往接受过1系列化疗(包括和不包括免疫治疗),72%的人既往未接受任何系统性抗癌治疗,22%的患者既往曾接受过1次系统性抗癌疗法。在第二个队列中,46名患者(82%)曾接受过克唑替尼(Xalkori)治疗,9名患者(16%)接受了恩曲替尼(Rozlytrek)治疗。
根据这项关键的注册试验的结果,美国食品药品监督管理局已经接受了雷普替尼治疗ROS1阳性、局部晚期或转移性NSCLC患者的新药申请,并授予其优先审查权,《处方药使用费法案》日期为2023年11月27日。
免责声明
由本文所表达的任何关于疾病的建议都不应该被视为医生的建议或替代品,请咨询您的治疗医生了解更多细节。本站信息仅供参考,医康行不承担任何责任。

扫码实时看更多精彩文章
