Jaypirca 获得 CLL/SLL 的加速批准
美国食品药品监督管理局(FDA)已加速批准Jaypirca (pirtobrutinib)用于治疗既往接受过至少2线治疗的慢性淋巴细胞白血病或小淋巴细胞淋巴瘤(CLL/SLL)成人患者,包括BTK抑制剂和BCL-2抑制剂。
加速批准基于1/2期BRUIN试验的数据(ClinicalTrials.gov 标识符:NCT03740529)。
该试验包括 108 名 CLL/SLL 患者,他们既往接受过至少 2 线治疗,包括 BTK 抑制剂和 BCL-2 抑制剂。在研究中,他们每天一次接受 200 毫克的 Jaypirca,直到疾病进展或出现不可接受的毒性。
总缓解率为72%(全部部分缓解)。中位随访时间为15.7个月,中位缓解持续时间为12.2个月。中位缓解时间为 3.7 个月。
在包括 593 名血液系统恶性肿瘤患者在内的完整研究人群中评估了 Jaypirca 的安全性。最常见的不良事件(见于 20% 或更多患者)是中性粒细胞计数减少、血红蛋白降低、疲劳、淋巴细胞计数减少、肌肉骨骼疼痛、血小板计数减少、腹泻、COVID-19、瘀伤和咳嗽。
Jaypirca是否继续获批用于CLL/SLL取决于验证性试验中对临床益处的验证和描述。据礼来公司称,BRUIN CLL-321试验(ClinicalTrials.gov 标识符:NCT04666038)将作为验证性试验。本研究旨在比较 Jaypirca 与 idelalisib 加利妥昔单抗或苯达莫司汀加利妥昔单抗治疗 CLL/SLL 患者。结果已与FDA共享,但尚未由该机构审查。
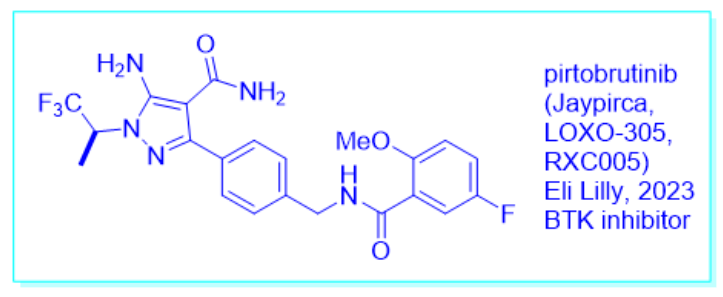
Jaypirca 以 50 毫克和 100 毫克强度的片剂形式提供。推荐剂量为 200 mg,口服,每日一次,直至疾病进展或出现不可接受的毒性。对于某些不良事件,以及严重肾功能不全的患者和服用强效 CYP3A 抑制剂或 CYP3A 诱导剂的患者,可能需要调整剂量。
免责声明
由本文所表达的任何关于疾病的建议都不应该被视为医生的建议或替代品,请咨询您的治疗医生了解更多细节。本站信息仅供参考,医康行不承担任何责任。

扫码实时看更多精彩文章
