恩诺单抗Enfortumab Vedotin - 尿路上皮癌
患有膀胱癌和尿路(输尿管、肾盂或尿道)癌症且已扩散或无法手术切除的个体可以使用处方药 Enfortumab vedotin 进行治疗。如果患者接受过含铂化疗和免疫治疗,或者之前接受过一种或多种治疗,并且没有资格接受涉及药物顺铂的化疗,则可以使用该药物。
在这种情况下,一种称为 Enfortumab vedotin 的抗体-药物组合用于治疗进行性、难治性尿路上皮恶性肿瘤患者。单甲基奥瑞他汀 E (MMAE) 是一种破坏微管的化疗药物,也是一种针对 Nectin-4 的全人源单克隆抗体,通过蛋白酶可裂解链接连接。它与 Brentuximab vedotin 相当,后者是另一种靶向 CD-30 而不是 Nectin-4 的 MMAE 偶联抗体。
Enfortumab vedotin是日本跨国制药公司安斯泰来制药公司与美国生物技术公司Seattle Genetics(现称为Seagen)合作开发的临床成果。它于 2019 年 12 月首次获准在美国使用,品牌名称为 PadcevTM。后来,在 2022 年 4 月,欧盟委员会批准了 Enfortumab vedotin。2019年获批用于治疗晚期膀胱癌的第二种靶向药物是Enfortumab vedotin。厄达替尼早前获得FDA(美国食品药品监督管理局)的快速批准。
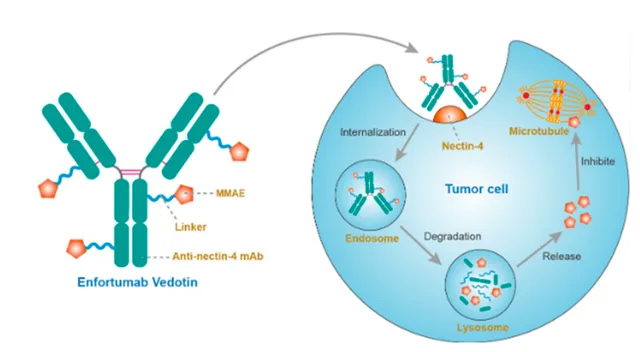
Enfortumab Vedotin 如何工作?
一种称为 Enfortumab vedotin 的抗体-药物组合由多个部分组成。单甲基 auristatin E (MMAE) 是一种化疗性微管破坏药物,与一种针对 Nectin-4 的全人源单克隆抗体有关,Nectin-4 是一种在尿路上皮恶性肿瘤中显着表达的细胞外粘附蛋白。可被蛋白酶分解的接头连接这两个部分。表达 Nectin-4 的细胞与 Enfortumab vedotin 结合,产生的 Enfortumab-Nectin-4 复合物被细胞内化。一旦进入细胞,MMAE 就会通过蛋白水解裂解从 Enfortumab vedotin 中释放出来,从而破坏微管网络,停止细胞周期,并最终触发细胞凋亡。
Enfortumab vedotin 是 Padcev 中的活性成分,由一种抗体(一种蛋白质)和另一种称为 MMAE(单甲基 auristatin E)的分子组成。在进入癌细胞之前,抗体首先与其表面的蛋白质结合。一旦活性成分进入细胞内,MMAE就会扰乱细胞的内部骨骼,导致细胞死亡,并有助于防止癌症恶化或扩散。
使用适应症:
Enfortumab vedotin 适用于既往接受过含铂化疗方案和 PD-1 或 PD-L1 抑制剂的新辅助或辅助化疗、局部晚期或转移性局部晚期或转移性局部晚期或转移性尿路上皮癌成人患者,或不适合接受含顺铂的化疗且既往接受过一线或多线治疗的成人患者。
Enfortumab Vedotin的剂量:
Enfortumab vedotin 的规定剂量是这样的,在 28 天周期的第 1、8 和第 15 天,应以 1.25 mg/kg(毫克/千克)的剂量静脉输注 30 分钟,对于小于或 100 千克的患者,最高限量为 125 mg,直到疾病进展或发生无法耐受的毒性。

该药物的禁忌症是什么?
这种药物没有禁忌症。
警告和注意事项:
1、皮肤反应
接受Enfortumab vedotin治疗的患者出现严重的皮肤不良反应,包括致命的Stevens-Johnson综合征(SJS)或中毒性表皮坏死松解症(TEN)。治疗的第一阶段是主要发生Stevens-Johnson综合征和中毒性表皮坏死松解症;但是,它们也可能在以后发生。在临床试验中接受药物治疗的 680 名患者中,55% 的患者出现皮肤反应;33%的患者感到瘙痒,23%的患者有斑丘疹,13%的患者出现3-4级皮肤反应,包括斑丘疹、红斑性皮疹、对称性药物相关性间擦和弯曲性皮疹(SDRIFE)、药疹、大疱性皮炎、剥脱性皮炎和掌跖性红肿。临床研究中出现严重皮肤反应的中位时间为六个月。发生皮肤反应导致剂量中断然后继续Enfortumab vedotin的患者在以相同剂量恢复时出现24%的病例复发性严重皮肤反应,在以较低剂量开始时出现16%的病例。在整个治疗过程中,应密切关注患者是否有任何皮肤反应。如果临床需要,考虑外用皮质类固醇和抗组胺药。应停用 Enfortumab vedotin,并将似乎患有 Stevens-Johnson 综合征、中毒性表皮坏死松解症或严重皮肤反应的患者转诊至专科医生治疗。确诊为 Stevens-Johnson 综合征或中毒性表皮坏死松解症以及 4 级或重复 3 级皮肤反应的患者应永久停止服用 Enfortumab vedotin。
2、周围神经病变
在临床试验中接受该药物的680名患者中,有52%的患者出现周围神经病变,其中39%患有感觉神经病变,7%患有肌肉无力,6%患有运动神经病变;4%的人有3至4级反应。接受 Enfortumab vedotin 治疗的患者出现周围神经病变,无论他们是否已经患有。2 级周围神经病变平均需要四个月才能开始。5%的神经病变患者停止服药。当周围神经病变出现时,应密切观察患者是否有任何新的或恶化的症状,并应中断或减少药物剂量。经历超过 3 级周围神经病变的个体,永久停止给药。
3、高血糖
接受Enfortumab vedotin治疗的患者出现糖尿病酮症酸中毒、高血糖和一些致命发作,伴或不伴有糖尿病病史。在临床研究中,接受Enfortumab vedotin治疗的680例患者中有7%出现3至4级高血糖,约占获得性高血糖患者的14%。随着时间的推移,体重指数较高的患者和基线 A1C 升高的患者 3 至 4 级高血糖的发生率有所上升。对于高血糖的治疗,5%的患者需要开始胰岛素治疗。出现高血糖前的中位时间为六个月。6%的患者因高血糖而停止药物治疗。糖尿病患者或有糖尿病风险的患者应密切监测血糖水平。如果血糖升高超过 250 mg/dL,则停用 Enfortumab vedotin。
4、眼部疾病
在计划进行眼科检查的临床研究中,40%的病例报告了接受Enfortumab vedotin治疗的眼部问题患者。这些事件大多影响角膜,与干眼症有关,包括角膜炎、视力受损、流泪增高、结膜炎、角膜缘干细胞功能不全和角膜病变。在Enfortumab vedotin治疗期间,34%的患者出现干眼症状,13%的患者出现视力受损。眼病症状平均需要一个半月才能出现。留意患者的眼部问题。考虑使用人工泪液来预防眼睛干涩,如果出现任何眼部症状或没有消失,请进行眼科检查。眼科检查后,如果建议使用局部眼用类固醇治疗,则这样做。对于有症状的眼部疾病,暂停 Enfortumab vedotin 剂量或减少剂量可能是一种选择。
5、肺炎
严重、致命或危及生命的肺炎发生在一些接受 Enfortumab vedotin 治疗的个体中。在临床研究中,接受药物治疗的680名患者中有3.1%患有任何级别的肺炎,0.7%患有3至4级肺炎。临床试验中肺炎发作的中位时间约为三个月。在放射学检查中观察患者的肺炎体征和症状,例如呼吸困难、咳嗽、缺氧和间质浸润。通过进行必要的检查,确定并排除这些体征和症状的感染性、肿瘤性和其他原因。对于复发性或持续性 2 级肺炎患者,应停用 Enfortumab vedotin,并考虑降低剂量。对于所有 3 级或 4 级肺炎患者,应永久停用 Enfortumab vedotin。
6、对胎儿或胚胎的毒性
根据其作用方法及其在动物中的结果,如果将Enfortumab vedotin给予孕妇,可能会伤害未出生的孩子。在器官发生阶段对怀孕大鼠施用 Enfortumab vedotin 导致母体暴露时的母体毒性、结构畸形、胚胎-胎儿致死和骨骼异常,与建议的人类剂量 1.25 mg/kg 的临床暴露大致相当。告知患者任何潜在的胎儿风险。告知有能力怀孕的女性患者在 Enfortumab vedotin 治疗期间和最终剂量后两个月内使用可靠的避孕措施。应告知男性患者在使用 Enfortumab vedotin 时使用可靠的避孕措施,如果他们有能够怀孕的女性伴侣,则在最后一次给药后 4 个月内应告知他们使用可靠的避孕措施。
7、输液部位外渗
在给予 Enfortumab vedotin 后,已经注意到与外渗相关的皮肤和软组织反应。在680名患者中,有1.6%的患者有软组织和皮肤反应,0.3%有3至4级反应。反应可能很慢。疼痛、红斑、水肿和体温升高都会加重,直到外渗后 2-7 天,然后在症状达到高峰后 1-4 周内消失。2 例患者出现外渗反应,伴有随后的蜂窝织炎、剥脱或大疱。在开始 Enfortumab vedotin 之前,请确保有足够的静脉通路,并留意可能发生的任何外渗。如果发生外渗,请停止输注,并注意任何负面影响。
对Enfortumab Vedotin的不良反应:
还描述了以下严重不良反应:皮疹。肾功能和肝功能检查的变化。血糖(葡萄糖)水平升高。疲劳。手、脚或其他身体部位肌肉无力或麻木。红细胞、血小板和白细胞数量减少。头发掉落。食欲下降。呕吐。降低血液中的白蛋白、钠和磷酸盐水平。麻刺感。味觉改变。血尿酸水平升高。脂肪酶升高(为检查胰腺而进行的血液检查)。体重减轻。皮肤干燥。
如果患者出现特定的副作用,保健医生可能会降低剂量,或暂时或永久停止药物治疗。使用 Enfortumab vedotin 的男性可能会遇到生育能力问题,这可能会影响他们的生育能力。如果您对生育有疑问,请咨询您的医生。
免责声明
由本文所表达的任何关于疾病的建议都不应该被视为医生的建议或替代品,请咨询您的治疗医生了解更多细节。本站信息仅供参考,医康行不承担任何责任。

扫码实时看更多精彩文章
