Elacestrant (ORSERDU™)治疗乳腺癌疗效如何?
Elacestrant (ORSERDU™) 是一种口服选择性雌激素受体降解剂 (SERD),由美纳里尼集团的子公司 Stemline Therapeutics 开发,用于治疗雌激素受体 (ER) 阳性、人表皮生长因子受体 2 (HER2) 阴性乳腺癌。2023年1月,elacesrant首次获批用于治疗ER阳性、HER2阴性、雌激素受体1(ESR1)突变(由美国FDA批准的检测确定)晚期或转移性乳腺癌的绝经后女性或成年男性,这些乳腺癌在美国接受≥一线内分泌治疗后出现疾病进展。
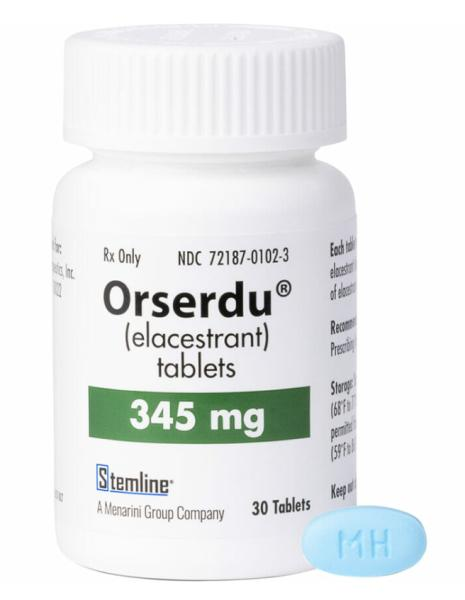
艾拉司群药物介绍
elacestran(ORSERDU™),由美纳里尼集团的子公司Stemline Therapeutics开发,用于治疗ER阳性、人表皮生长因子受体2(HER2)阴性乳腺癌。2023年1月27日,elacesrant在美国首次获批用于治疗ER阳性、HER2阴性、ESR1突变(由美国FDA批准的检测确定)晚期或转移性乳腺癌的绝经后女性或成年男性,这些乳腺癌在接受≥线内分泌治疗后出现疾病进展。
Elacestrant 有 345 mg(相当于 400 mg elacestrant dihydrochloride)和 86 mg(相当于 100 mg elacestrant dihydrochloride)片剂 。推荐剂量为 345 毫克,口服给药,每日一次,直至疾病进展或出现不可接受的毒性。Elacestrant 应整个吞咽并与食物一起服用(以减少恶心和呕吐),并且每天大约在同一时间服用。对于发生不良反应和中度肝功能损害的患者,应查阅当地处方信息,以获取有关剂量调整建议的信息。对于接受强或中度细胞色素P450(CYP)3A4诱导剂和抑制剂的患者以及重度肝功能损害患者(Child-Pugh C),应避免使用elacestrant。
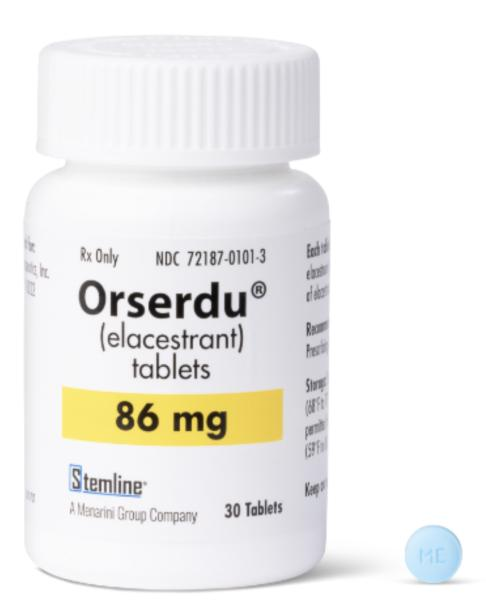
elacestran(ORSERDU™)临床效果如何?
与标准治疗单药治疗相比,口服依拉司坦单药治疗显著降低了参与一项随机、开放标签、多国III期研究的ER阳性、HER2阴性晚期或转移性乳腺癌绝经后女性和成年男性的疾病进展或死亡风险[EMERALD(NCT03778931)。符合本研究条件的患者患有经组织学或细胞学证实的疾病,在接受一种或两种既往内分泌治疗(其中一种含有 CDK4/6 抑制剂与氟维司群或芳香化酶抑制剂联合使用)治疗期间或治疗后 28 天内进展。允许在晚期或转移性情况下进行一线化疗。患者接受345mg乙酯剂,每日1次或SOC(阿那曲唑、依西美坦、氟维司群或来曲唑;均根据其标签给药),直至疾病进展或出现不可接受的毒性。
在中位随访时间为15.1个月(数据截止时间为2021年9月6日)时,中位盲法独立中心评价(BICR)评估的无进展生存期(PFS)[主要终点]为2.8个月(n=239),SOC为1.9个月(n=238)[风险比(HR)0.70(95%CI 0.55-0.88);p=0.002],使用elacestran组为3.8个月(n=115),SOC组为1.9个月(n=113)[HR 0.55(95%CI 0.39–0.77);p = 0.0005],在ESR1突变群体中。 在具有里程碑意义的分析中,在总体人群中,治疗组的BICR PFS率为34.3%,SOC组在6个月时为20.4%,12个月时为22.3%,9.4%,18个月时为16.8%,18个月时为0%,ESR1突变组在6个月时为40.8%,19.1%,12个月时为26.8%,12个月时为26.8%,18个月时为24.3%,18个月时为0%。 在预先指定的亚组中,BICR评估的PFS的HR在数值上优于SOC,交互作用p值表明,elacestran在该终点上的益处与亚组无关。在进行PFS分析时,进行了预先指定的中期总生存期(OS;关键次要终点)分析。此时,所有患者共发生149例事件[HR 0.75(95%CI 0.54-1.04)],ESR1突变患者发生68例事件[HR 0.59(95%CI 0.36-0.96);p = 0.03(不显著)]。当≈50%的患者死亡时,将进行最终OS分析。
在对总体人群数据的最新分析中,在接受 ≥ 6 个月的既往内分泌加 CDK4/6 抑制剂治疗、3.8 个月的 elacestrant (n = 202) 和 1.9 个月的 SOC (n = 205) [HR 0.69 (95% CI 0.54–0.88)] 的患者中位 PFS 为 2.8 个月,接受 elacestrant 治疗 3.8 个月 (n = 150) 和 1.9 个月= 160) [HR 0.61 (95% CI 0.45–0.83)] 在既往接受过≥ 12个月的内分泌加CDK4/6抑制剂治疗的患者中,接受过 5.5 个月的依拉雌林治疗 (n = 98) 和 3.3 个月的 SOC 治疗 (n = 119) [HR 0.70 (95% CI 0.48–1.02)] [HR 0.70 (95% CI 0.48–1.02)] 在既往接受过 ≥ 18 个月的内分泌联合 CDK4/6 抑制剂治疗的患者中 。在对 ESR1 突变群体数据的最新分析中,接受 ≥ 6 个月内分泌加 CDK4/6 抑制剂治疗、8.6 个月接受 elacestrant (n = 78) 和 1.9 个月 SOC (n = 102) 的患者的中位 PFS 为 4.1 个月,SOC 为 1.9 个月 (n n在既往接受过≥12个月的内分泌加CDK4/6抑制剂治疗的患者中,接受12个月的内分泌加CDK4/6抑制剂治疗的患者,以及接受8.6个月的elacestron治疗(n=55)和2.1个月的SOC(n=56)[HR 0.47(95%CI 0.20–0.79)]的受试者≥18个月。
有症状的转移性内脏疾病患者,以及在入组后6个月内发生过各种心血管事件(包括凝血功能障碍(血栓形成)、冠状动脉/外周动脉旁路移植术、心肌梗死、纽约心脏协会II.级或更严重心力衰竭、持续≥2级心律失常、重度/不稳定型心绞痛和不受控制的心房颤动]的患者被排除在EMERALD组之外。根据ESR1突变状态(检测到与未检测到)、是否存在内脏转移(是与否)和既往氟维司群治疗(是与否)对治疗组(elacestran或SOC)进行随机分层。基线时,患者中位年龄为 63 岁;477例患者中,47.8%的患者可检测到ESR1突变,43.4%的患者既往接受过两线内分泌治疗。
EMERALD的研究结果得到了ER阳性、HER2阴性局部晚期和/或转移性乳腺癌患者经过大量预处理的绝经后妇女的疗效数据的支持,这些妇女参与了一项开放标签、多中心、I期剂量递增研究(NCT02338349)。在反应可评估人群(n = 31,接受 elacestrant 345 mg 每日一次)中,6 例 (19.4%) 患者 [包括既往接受过 CDK4/6 抑制剂 (16.7%) 和既往 SERD (15.0%) 治疗的患者] 出现部分缓解,12 例 (38.7%) 患者病情稳定。中位缓解时间和中位持续时间分别为 1.9 个月和 5.8 个月。在临床获益可评估人群(n = 47,接受 elacestrant 345 mg 每日一次)中,临床获益率(定义为部分缓解加上疾病稳定≥ 24 周)为 42.6%,中位 PFS 为 4.5 个月。NCT02338349患者接受治疗,直到疾病进展或无法耐受。在基线 (n = 50) 时,患者中位年龄为 63 岁,50% 的患者具有可检测到的 ESR1 突变。患者既往接受过3种抗肿瘤治疗的中位数[包括CDK4/6抑制剂(52%)和SERDs(52%)]。
免责声明
由本文所表达的任何关于疾病的建议都不应该被视为医生的建议或替代品,请咨询您的治疗医生了解更多细节。本站信息仅供参考,医康行不承担任何责任。

扫码实时看更多精彩文章
