艾伏尼布获得IDH1突变复发或难治性MDS的优先审查
TIBSOVO目前在美国被批准作为单一疗法用于治疗IDH1突变复发或难治性AML成人患者,以及单药治疗或与阿扎胞苷联合用于新诊断的IDH1突变AML成人患者,年龄≥75岁或合并症排除使用强化诱导化疗。
TIBSOVO最近被欧盟委员会批准为两种适应症的靶向治疗:与阿扎胞苷联合用于治疗新诊断的具有异柠檬酸脱氢酶-1(IDH1)R132突变的新诊断急性髓系白血病(AML)成年患者,这些患者不符合接受标准诱导化疗的条件;以及用于治疗具有 IDH1 R132 突变的局部晚期或转移性胆管癌成年患者的单药治疗,这些患者既往接受过至少一线全身治疗。
TIBSOVO也已在美国和澳大利亚被批准用于既往接受过治疗的IDH1突变胆管癌患者。TIBSOVO在中国也被批准用于治疗具有易感IDH1突变的复发或难治性AML成年患者。施维雅已授予基石药业在中国大陆、中国台湾、中国香港、中国澳门和新加坡开发的共同独家许可和TIBSOVO商业化的独家许可协议。
最新消息是美国食品药品监督管理局 (FDA) 已批准对 ivosidenib (Tibsovo) 作为 IDH1 突变、复发或难治性骨髓增生异常综合征 (MDS) 患者的治疗方法进行优先审查。
MDS适应症的补充新药申请得到了1期开放标签研究(ClinicalTrials.gov 标识符:NCT02074839)的数据的支持,该研究包括18名IDH1突变,复发或难治性MDS患者。
sNDA基于一项针对IDH1突变R/R MDS患者的关键1期开放标签研究的关键结果,在该研究中,TIBSOVO表现出持久的缓解,包括近40%的患者完全缓解,以及可接受的安全性。更新后的疗效结果在2023年欧洲血液学协会(EHA)大会上公布。
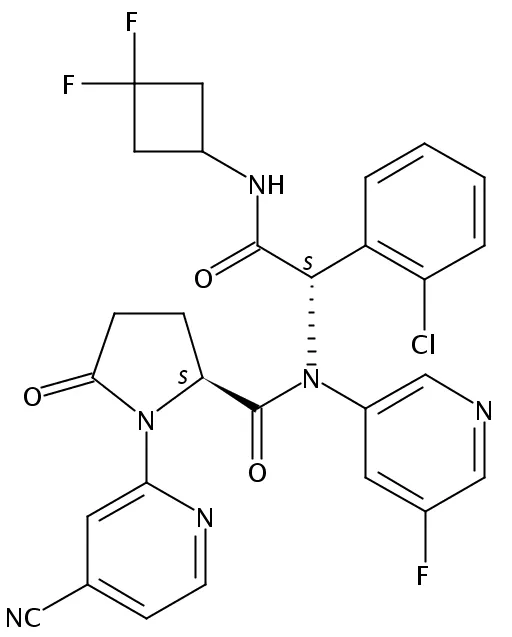
这些发现表明,在疗效分析集中(n=18),接受TIBSOVO治疗的患者的完全缓解率(CR)为38.9%,客观缓解率(ORR)为83.3%。此外,中位CR时间为1.87个月(范围:1.0,5.6)。在数据截止时,中位持续时间尚未达到(范围:1.9,80.8*),中位总生存期为35.7个月。此外,在基线时对红细胞或血小板有输血依赖性的9名患者中,66.7%(n=6)在基线后任何≥56天的时间内独立于输血。
总体而言,与治疗相关的不良事件与TIBSOVO的已知安全性一致。在这项研究中没有发现新的安全信号。
免责声明
由本文所表达的任何关于疾病的建议都不应该被视为医生的建议或替代品,请咨询您的治疗医生了解更多细节。本站信息仅供参考,医康行不承担任何责任。

扫码实时看更多精彩文章
