厄达替尼(盼乐)说明书,适应症,作用效果,用法用量及副作用
根据发表在《柳叶刀肿瘤学》上的研究结果,关键的2期BLC2001研究的长期随访显示,泛FGFR抑制剂埃达非替尼(Balversa)对局部晚期或转移性尿路上皮癌患者持续有效。
在中位随访24个月时,埃达非替尼的客观有效率为40%,包括4.0%的完全有效率和36.0%的部分有效率。与初步分析的安全性数据相比,延长随访没有出现新的安全性信号。以下为厄达替尼(盼乐)说明书,适应症,作用效果,用法用量及副作用详细介绍。
厄达替尼(盼乐)适应症
埃尔达非替尼被批准用于治疗:尿路上皮癌(癌症的一种类型),其已经扩散或不能通过手术切除,并且在FGFR3基因或涉及FGFR3或FGFR2基因的融合基因中具有某些突变。它用于癌症在接受至少一种铂类化疗期间或之后病情恶化的成年人。
这种用途是根据美国食品药品监督管理局的加速批准计划批准的。作为批准的条件,验证性试验必须证明埃达非替尼对这些患者具有临床益处。
厄达替尼(盼乐)推荐用量
尿路上皮癌的常用成人剂量:8 mg,口服,每日一次;根据血清磷酸盐水平和 9 至 14 天的耐受性增加至 21 mg,口服,每日一次,直至疾病进展或不可接受的毒性
用途:用于治疗局部晚期或转移性尿路上皮癌 (mUC) 成人患者,这些患者具有易感的 FGFR3 或 FGFR2 基因改变,并且在至少一线既往含铂化疗期间或之后进展,包括在新辅助或辅助含铂化疗后 12 个月内。
建议患者用水吞服整片药片。建议患者不要咀嚼、压碎、溶解或切割药片。无论有没有食物都可以吃。如果在服用厄达非替尼后不久呕吐,或者是当天忘记服用,请不要服用另一剂。等到下一次预定的给药时间再次服药。不应在一天内使用两剂。
厄达替尼(盼乐)的注意事项
眼部疾病
BALVERSA可引起眼部疾病,包括中枢浆液性视网膜病变/视网膜色素上皮脱离(CSR / RPED),导致视野缺损。
据报道,25% 的 BALVERSA 治疗患者出现 CSR/RPED,首次发病的中位时间为 50 天。3% 的患者报告了涉及中央视野的 3 级 CSR/RPED。CSR/RPED 在 13% 的患者中消退,在研究截止时在 13% 的患者中持续存在。CSR/RPED 分别导致 9% 和 14% 的患者剂量中断和减少,3% 的患者停用 BALVERSA。
在接受BALVERSA治疗期间,28%的患者出现干眼症状,3%的患者出现6级干眼症状。所有患者均应根据需要接受眼部缓和剂干眼症预防治疗。
在治疗的前 4 个月和治疗后的每 3 个月每月进行一次眼科检查,并随时紧急检查视力症状。眼科检查应包括视力评估、裂隙灯检查、眼底镜检查和光学相干断层扫描。
当 CSR 发生时,暂停 BALVERSA,如果 4 周内未解决或严重程度为 4 级,则永久停用。对于眼部不良反应,请遵循剂量调整指南。
高磷血症和软组织矿化
BALVERSA可引起高磷血症,导致软组织矿化,皮肤钙质沉着症,非尿毒症钙化和血管钙化。磷酸盐水平的增加是BALVERSA的药效学作用[见药效学]。据报道,高磷血症在接受BALVERSA治疗的患者中有76%是不良反应。任何等级的高磷血症事件的中位发病时间为开始 BALVERSA 后 20 天(范围:8-116)。0%的患者在用BALVERSA治疗期间接受了磷酸盐结合剂。在接受BALVERSA治疗的患者中,3.<>%观察到皮肤钙质沉着症,非尿毒症性钙化反应和血管钙化。
在整个治疗过程中监测高磷血症。在所有患者中,将磷酸盐摄入量限制在每日 600-800 mg。如果血清磷酸盐高于 7.0 mg/dL,考虑添加口服磷酸盐结合剂,直到血清磷酸盐水平恢复到 <5.5 mg/dL。根据表2根据高磷血症的持续时间和严重程度,保留,剂量减少或永久停止BALVERSA
胚胎-胎儿毒性
根据作用机制和动物生殖研究中的发现,BALVERSA在给予孕妇时可引起胎儿伤害。在胚胎 - 胎儿毒性研究中,在器官发生期间向怀孕大鼠口服厄达非替尼导致母体暴露时的畸形和胚胎 - 胎儿死亡,低于基于曲线下面积(AUC)的最大人类推荐剂量下的人类暴露。告知孕妇对胎儿的潜在风险。建议有生殖能力的女性患者在BALVERSA治疗期间和最后一次给药后一个月使用有效的避孕措施。建议有生殖潜力的女性伴侣的男性患者在用BALVERSA治疗期间和最后一次给药后一个月使用有效的避孕措施。

厄达替尼(盼乐)治疗尿路上皮癌的效果
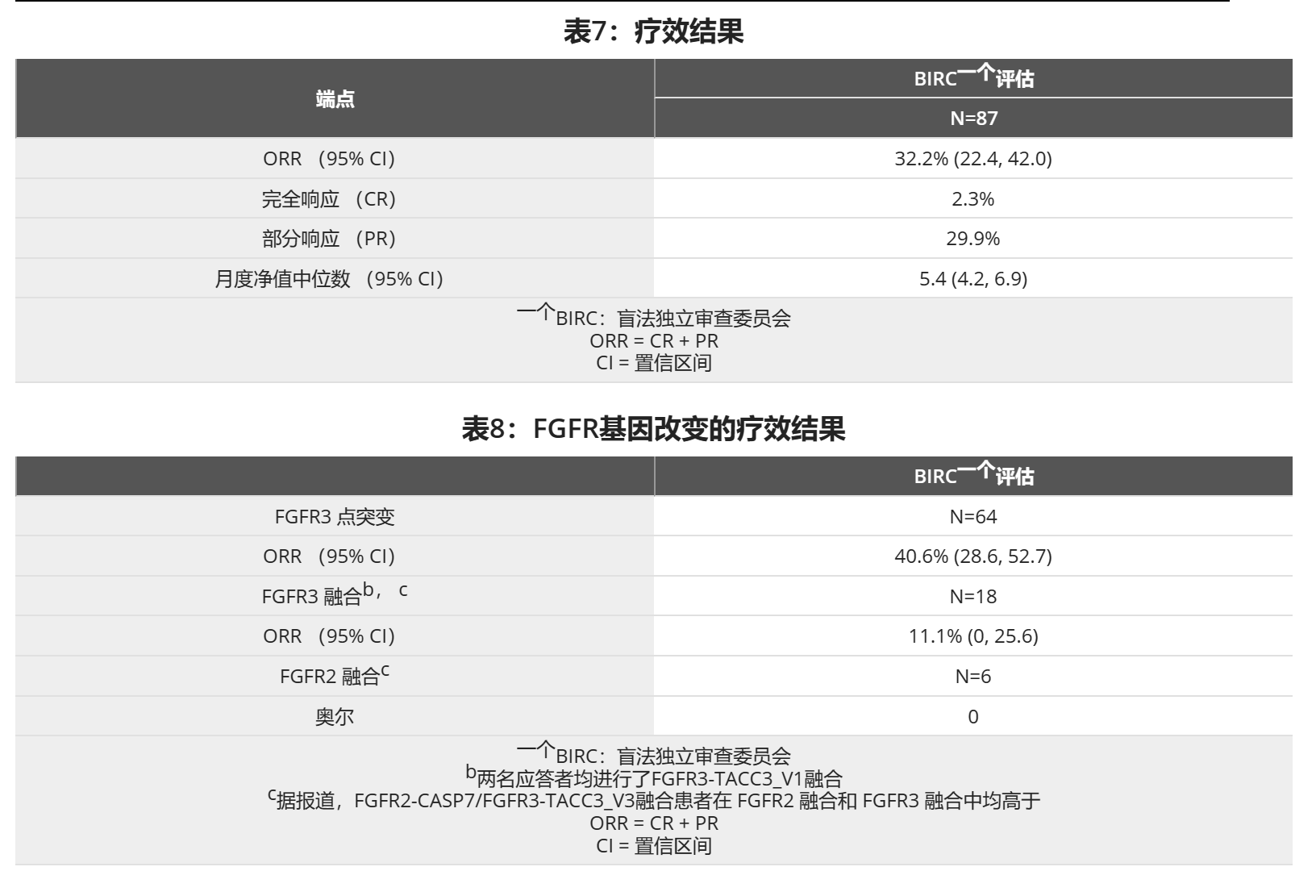
研究BLC2001(NCT02365597)是一项多中心、开放标签、单臂研究,旨在评估BALVERSA在局部晚期或转移性尿路上皮癌(mUC)患者中的疗效和安全性。用于筛查和入组患者的成纤维细胞生长因子受体 (FGFR) 突变状态通过临床试验测定 (CTA) 确定。疗效人群包括一组 1 名患者,他们入组本研究的疾病在至少一次先前化疗时或之后进展,并且至少有以下遗传改变之一:FGFR3 基因突变(R248C、S249C、G370C、Y373C)或 FGFR 基因融合(FGFR3-TACC3、FGFR3-BAIAP2L1、FGFR2-BICC1、FGFR2-CASP7),由 CTA 在中心实验室进行测定。来自69名患者的肿瘤样本由QIAGEN therascreen FGFR RGQ RT-PCR试剂盒进行回顾性测试,该试剂盒是FDA批准的用于选择BALVERSA的mUC患者的测试。
在第8天和第9天之间血清磷酸盐水平低于5.5mg / dL目标的患者中,患者接受14mg的BALVERSA起始剂量,每日一次,剂量增加至17mg每日一次;41%的患者剂量增加。BALVERSA施用至疾病进展或不可接受的毒性。主要疗效结局指标是客观缓解率(ORR)和缓解持续时间(DoR),由盲法独立审查委员会(BIRC)根据RECIST v1.1确定。
中位年龄为67岁(范围:36至87岁),79%为男性,74%为高加索人。大多数患者(92%)的基线东方肿瘤协作组(ECOG)表现状态为0或1。66%的患者有内脏转移。84名(97%)患者以前至少接受过一种顺铂或卡铂治疗。56%的患者先前只接受了基于顺铂的方案,29%的患者先前仅接受了基于卡铂的方案,10%的患者同时接受了基于铂和顺铂的方案。三(3%)名患者在先前的含铂新辅助或仅辅助治疗后出现疾病进展。24%的患者曾接受过抗PD-L1/PD-1治疗。
疗效结果总结于表7和表8。总缓解率为32.2%。应答者包括以前对抗PD-L1/PD-1治疗无反应的患者。
厄达替尼(盼乐)严重副作用
如果您有以下严重的副作用,请立即就医:
1、严重的眼部症状,如突然视力丧失、视力模糊、隧道视力、眼睛疼痛或肿胀,或看到灯光周围有光晕;
2、 严重的心脏症状,如心跳加快、不规则或剧烈;在你的胸口颤动;呼吸急促;以及突然头晕、头晕或昏倒;
3、严重头痛、意识模糊、言语不清、手臂或腿部无力、行走困难、失去协调、感觉不稳、肌肉非常僵硬、高烧、大量出汗或震颤。
免责声明
由本文所表达的任何关于疾病的建议都不应该被视为医生的建议或替代品,请咨询您的治疗医生了解更多细节。本站信息仅供参考,医康行不承担任何责任。

扫码实时看更多精彩文章
