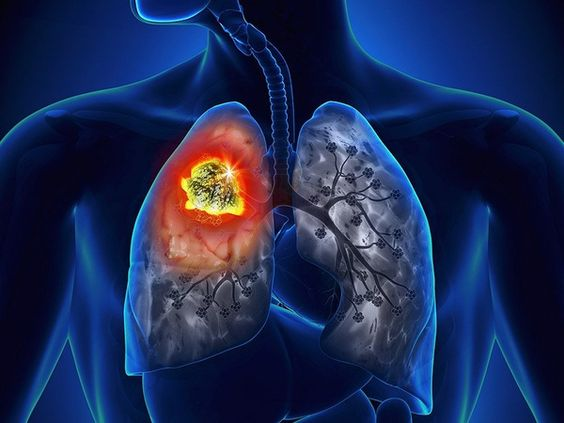
AMG510/索托拉西布治疗肺癌的试验数据如何?
ARS-1620是安进研究团队经过深入的亲电试剂筛选和结构基础设计后,发现的第一个导致AMG510开发的临床前工具化合物。在临床前研究中,AMG510治疗导致了持久的肿瘤消退和发炎的肿瘤微环境。
Sotolasib(AMG510)是一种高度选择性和不可逆的KRASG12C抑制剂,其在变构口袋(开关II口袋S-IIP)结合,导致KRAS被捕获在非活性GDP结合状态。在一项1期、多中心开放标签试验中,纳入了至少3个(60.5%)癌症特异性治疗前系列的重度预处理患者(n=129),中位随访时间为11.7个月。未观察到剂量限制性毒性作用。
最常见的不良事件是腹泻(38例[29.5%])、疲劳(30例[23.3%])和恶心(27例[209%])。11.6%的患者报告了3级治疗相关不良事件,包括天冬氨酸转氨酶(AST)/丙氨酸转氨酶(ALT)/碱性磷酸酶(alk-phos)升高、贫血、肝炎、腹泻、低钠血症。疗效分析显示,在所有剂量水平下,NSCLC患者的客观有效率为32.2%,在960 mg目标剂量下为35.3%,中位反应持续时间为10.9个月,中位缓解时间为1.4个月,无进展生存期为6.3个月。
在Codebreak-100试验的2期部分(NCT036000883)中,对在先前标准治疗中取得进展的局部晚期或转移性NSCLC患者进行了索托拉西960 mg的评估,每天一次,中位随访时间为15.3个月。在124名可测量疾病的患者中,46名患者(37.1%)获得了肿瘤缓解,完全缓解率(CR)为3.2%,部分缓解率(PR)为33.9%。疾病控制率超过80%(100名患者;80.6%),中位缓解时间为11.1个月。PFS中位数为6.8个月,OS中位数为12.5个月。
根据PDL1的表达、肿瘤突变负荷和STK11、KEAP1或TP53的共发生突变,在亚组中观察到反应。在评估PDL1表达的86名患者中,48%的PDL1阴性患者有客观反应,而总人群的反应率为42%。类似地,42%的低肿瘤突变负荷组有反应,而高肿瘤突变负荷的组有40%的反应。在具有突变的STK11和野生型KEAP1的患者中,50%的患者出现应答,在具有突变STK11与KEAP1两者的患者中为23%,在具有野生型STK11及突变KEAP1者中为14%。最常见的任何级别的治疗相关不良事件是腹泻(31.7%)、丙氨酸氨基转移酶水平升高(15.1%)和疲劳(11.1%)。没有发现致命的治疗相关的不良事件。22.2%和7.1%的患者出现了导致剂量改变的治疗相关不良事件。
根据安全性和有效性结果,索托拉西于2021年5月28日获得美国食品药品监督管理局(FDA)的正式有条件批准。索托拉西布在结直肠癌癌症中的活性已从早期研究中发表、。尽管看到了一些疾病的稳定性,客观反应为7.1%,但作为单一制剂的活性似乎是有限的。因此,索托拉西布的批准仅适用于KRAS G12C NSCLC患者。

目前,验证性3期临床试验(NCT04303780,Codebreak 200)正在评估索托拉西布对抗多西他赛治疗二线转移性NSCLC的疗效。还有其他正在进行的试验评估索托拉西布作为KRAS G12C突变肺癌癌症或其他实体瘤的单药治疗或联合治疗(NCT0418583[Codebreak 101])、NCT04667234[扩展访问]、NCT04625647[LUNGMAP]、NCTO4380753[Codebreak105中国民族敏感性研究]、NCTO 418583)。
Codebreak 101的1期研究正在招募携带KRAS G12C突变的晚期实体瘤患者,以评估索托拉西布与曲美替尼、RMC-4630(SHP2抑制剂)、阿法替尼、免疫疗法(pembrolizumab、AMG404)、化疗(卡铂/培美曲塞/多西他赛)和其他药物的联合作用。尽管960 mg每日的拟议给药方案得到了疗效和安全性数据的支持,但考虑到作用机制、观察到的PK、RR缺乏临床剂量-反应关系、高剂量的潜在胃肠道毒性以及患者的高药丸负担,美国食品药品监督管理局最近提出了一项要求,要求进行一项随机试验,将960 mg的当前标准剂量与240 mg的“较低日剂量”进行比较。人们将热切期待低剂量研究的疗效和安全性数据。
免责声明
由本文所表达的任何关于疾病的建议都不应该被视为医生的建议或替代品,请咨询您的治疗医生了解更多细节。本站信息仅供参考,医康行不承担任何责任。

扫码实时看更多精彩文章
